운동중재가 투석 전단계 만성 신질환 노인의 신체기능 및 신기능 향상에 미치는 효과: 체계적 문헌고찰 및 메타분석
Effectiveness of exercise for improving physical and renal function in older adults with pre-dialysis chronic kidney disease: A systematic review and meta-analysis
Article information
Trans Abstract
Purpose
Exercise may prevent the worsening of chronic kidney disease (CKD) and progression of cardiovascular diseases in patients with CKD. This review aims to identify the best type of exercise modality and summarizes the beneficial effects of exercise on physical and renal function among older adults with pre-dialysis CKD.
Methods
A systematic search of PubMed, Embase, CINAHL, Cochrane Library, Web of Science, SCOPUS, and domestic database was performed for randomized controlled trials (RCTs) assessing the effect of exercise intervention on older adults with pre-dialysis CKD published until February 2023. A random-effects meta-analysis was conducted. The risk of bias was assessed using a Cochrane tool for assessing the risk of bias in RCTs (RoB 2.0).
Results
The systematic review included 11 RCTs (n=591, average age 60.2–76), of which 8 could be included for meta-analysis. Exercise was significant in increasing peak oxygen consumption and knee muscle strength among physical functions, and also in improving glomerular filtration rate among kidney functions.
Conclusion
Exercise has beneficial effects on physical and renal function among older adults with pre-dialysis CKD. In the future, it is necessary to verify the effectiveness of exercise by subdividing it by type, intensity, duration, and delivery.
I. 서 론
1. 연구의 필요성
만성 신질환(Chronic Kidney disease, CKD)은 신장의 구조 또는 기능의 손상이 3개월 이상 지속적으로 나타나는 질병으로[1] 세계적인 건강문제 중 하나이다. 만성 신질환의 전 세계적 유병률은 11∼13%로 높은 편이며[2] 국내에서도 인구 고령화와 함께 만성 신질환 유병률이 연평균 8.7%씩 증가추세를 보이고 있어 중요한 건강문제로 대두되고 있다[3]. 더욱이 만성 신질환의 원인이 되는 고혈압 및 제2형 당뇨병의 유병률 증가는 만성 신질환으로 인한 사회경제적 부담 및 사망률 증가와 관련이 있어 보건의료 전반에 걸친 사회적 문제가 되고 있다[4].
만성 신질환은 사구체 여과율의 감소뿐만 아니라 근육소모로 신체기능 저하도 나타난다. 이는 질병의 진행과정에서 나타나는 비정상적인 대사작용으로 인해 근골격계의 구조 및 기능이 저하되어 근육의 위축 및 운동능력이 쇠퇴되기 때문이다[5]. 이러한 신체기능의 감소는 삶의 질 저하와 관련이 있으며 심혈관질환의 이환 및 사망 위험률을 증가시킬 수 있다[6]. 특히 만성 신질환을 앓고 있는 노인은 연령이 증가됨에 따라 근육의 소모 및 신기능 악화가 가속화되기 때문에 젊은 연령에 비해 더욱 세심한 건강관리가 요구된다. 선행연구에서 만성 신질환을 앓고 있는 고령 환자는 젊은 환자에 비해 심혈관 질환 위험요인을 포함한 동반질환의 비율이 높고, 만성 신질환 관련 신체기능 장애의 비율이 높게 나타났다[7,8]. 이러한 이유로 만성 신질환의 악화를 예방하기 위한 방법으로 운동이 추천된다.
운동은 만성 신질환자의 허약감 증상을 개선하고 근육량 증가를 통해 신체적 기능을 향상 시킬 수 있는 필수적인 비약물적 방법으로[9], National Kidney Foundation은 만성 신질환자의 신체활동을 높이기 위한 건강전략으로 운동이 필요하다고 강조하였다[5]. 선행연구 중 만성 신질환 환자 1,863명을 대상으로 운동중재를 적용한 연구에 따르면, 규칙적인 운동은 신체기능, 심혈관계 관련 지표 및 건강 관련 삶의 질을 향상시켰으며[10], 투석 중 운동을 실시한 17편의 연구를 체계적으로 고찰한 연구에서는 우울과 산소소비량 및 삶의 질이 개선되는 결과를 얻었다[11]. 그 외의 선행연구들에서도 규칙적인 운동은 만성 신질환 환자의 체력, 근육량 및 신체기능 개선에 영향을 미친다고 보고하였다[5,8]. 특히, 투석 전 단계에서 수행하는 규칙적인 운동은 광범위한 조직손상과 심각한 동반질환이 발생하기 전에 심혈관 질환의 진행을 예방할 수 있고, 신체기능 개선 및 신기능을 유지할 수 있다[12,13]. 그러나 운동중재 프로그램을 실시한 선행연구들에서는 말기신부전 환자(End-Stage Renal Failure, ESRD), 투석 중인 환자, 신장이식을 받은 환자들을 대상으로 시행되어[10,11] 투석 전 단계에서 실시한 운동중재가 노인에게 미치는 효과에 대해서 분석한 연구는 미흡한 실정이다. 투석 전 단계의 운동은 만성신질환 노인의 건강개선에 잠재적 이익이 있기 때문에 운동중재의 특성을 파악하고 그 효과를 확인할 필요가 있다. 이에 본 연구는 지금까지 투석 전 단계인 만성 신질환 노인에게 적용된 운동중재의 특성과 중재효과를 분석한 무작위 대조군 실험연구를 중심으로 체계적 문헌고찰과 메타분석을 시행하여 만성 신질환 노인의 신체기능 및 신기능 관리를 위한 맞춤형 운동중재 개발의 근거를 제시하고자 시도되었다.
2. 연구목적
본 연구의 목적은 투석 전 단계인 만성 신질환 노인을 위해 국내⋅외에서 시행된 운동중재 문헌의 특성과 신체기능 및 신기능 향상에 미치는 효과를 체계적으로 고찰하고, 메타분석을 통해 중재의 효과크기를 확인하기 위함이다.
II. 연구방법
1. 연구설계
본 연구는 투석 전 단계인 만성 신질환 노인을 대상으로 적용한 운동중재 문헌의 중재 특성과 신체기능 및 신기능 향상 효과를 분석하기 위한 체계적 문헌고찰 및 메타분석 연구이다.
2. 핵심질문
1) 문헌검색 전략
본 연구는 Cochrane Handbook for Systematic Reviews of Interventions[14]과 Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) 2020 Checklist [15] 및 한국보건의료연구원의 NECA 체계적 문헌고찰 매뉴얼에 따라 시행되었다. 또한 본 연구의 프로토콜은 Prospective Register of Systematic Reviews (PROSPERO)에 등록 및 승인 후 수행되었다(CRD42023412474).
2) 핵심질문
체계적 문헌고찰을 수행하기 위해 핵심질문은 Participants, Interventions, Comparisons, Outcomes, Study Design(PICO-SD) framework 기준에 따라 문헌의 선정기준을 다음과 같이 정하였다. (1) 연구대상(Participants)은 만성 신질환의 단계가 2∼4단계에 속하거나 사구체여과율이 15ml/min/1.73m2 이상인 투석 전 단계에 속하는 만 60세 이상인 환자이며 (2) 중재(Interventions)는 신체기능과 신기능 향상을 위해 수행된 유산소운동, 근력운동, 복합운동을 포함하였다. (3) 비교대상(Comparisons)은 운동중재를 제공받지 않거나 통상적 관리를 제공한 중재이며, (4) 중재결과(Outcomes)는 운동중재를 시행한 전, 후의 신체기능 또는 신기능을 측정한 평균값, 표준편차 및 표준오차 값을 포함하였으며, (5) 연구설계는 무작위 대조군 실험설계(Randomized controlled trial, RCT)로 하였다.
배제기준은 (1) 약물중재를 병용한 연구 (2) 신장이식 대상자가 포함된 연구 (3) 한국어나 영어로 출판되지 않은 연구로 설정하였다.
3) 문헌검색
본 연구의 문헌검색 기간은 각 데이터베이스가 자료를 제공하는 시기부터 2023년 2월 28일까지 국내⋅외 학술지에 게재된 문헌을 대상으로 하였다. 국외의 검색 데이터베이스는 PubMed, Embase, CINAHL, Cochrane Library, Web of Science, SCOPUS를 사용하여 검색하였으며, 국내의 검색 데이터베이스는 학술연구정보서비스(RISS), 한국학술정보(KISS), 과학기술정보통합서비스(NDSL), 학술데이터베이스서비스(DBpia) 및 국회도서관의 학술연구를 기반으로 검색하였다. 누락되는 문헌을 최소화하기 위해 문헌에 제시된 참고문헌을 바탕으로 수기검색을 시행하였다. 검색어는 핵심질문(PICO)을 바탕으로 Medical Subject Headings (MeSH) terms 과 Embase Tree (Emtree)를 이용하여 연구대상자(P)는(Renal insufficiency, Chronic[MeSH Terms]) OR (chronic kidney*) OR (chronic renal*) OR (CKD) OR (Chronic Kidney Disease) OR (kidney failure) OR (kidney insufficiency) OR (renal disease) OR (renal failure) OR (renal insufficiency) OR (predialy*) OR (Kidney Impairment) OR (kidney dysfunction)로 하였으며, 중재(I)는 (Exercise [MeSH Terms]) OR (resistance exercise) OR (resistance training) OR (strength training) OR (concurrent) OR (aerobic)을 사용하였다. 국내 데이터베이스 검색에 사용된 용어는 ‘만성 신질환’, ‘만성 신부전’, ‘만성 콩팥병’, ‘운동’, ‘유산소’, ‘근력’으로 설정하였다.
4) 문헌선정 및 자료추출
본 연구는 PICO-SD에 따른 선정기준 및 배제기준에 따라 문헌을 선정하고 PRISMA 흐름도를 이용하여 문헌의 단계별 선택과정을 나타내었다. 먼저 데이터베이스를 통해 문헌을 검색하였으며, 추가로 선행논문의 참고문헌에서 문헌을 수기로 수집하였다. 서지 관리 프로그램(EndNote 20)을 이용하여 중복된 문헌을 제거한 후 연구자 2인이 독립적으로 제목과 초록을 중심으로 검토하였고, 서로 다른 의견이 있는 경우 제 3의 연구자와 합의를 통해 결정하였다. 이후 문헌의 전문을 확인하여 최종 분석 문헌을 선정하였다. 자료추출은 연구자 2인이 독립적으로 수행 후 의견이 다를 시 토의하여 진행하였다.
3. 문헌의 질 평가
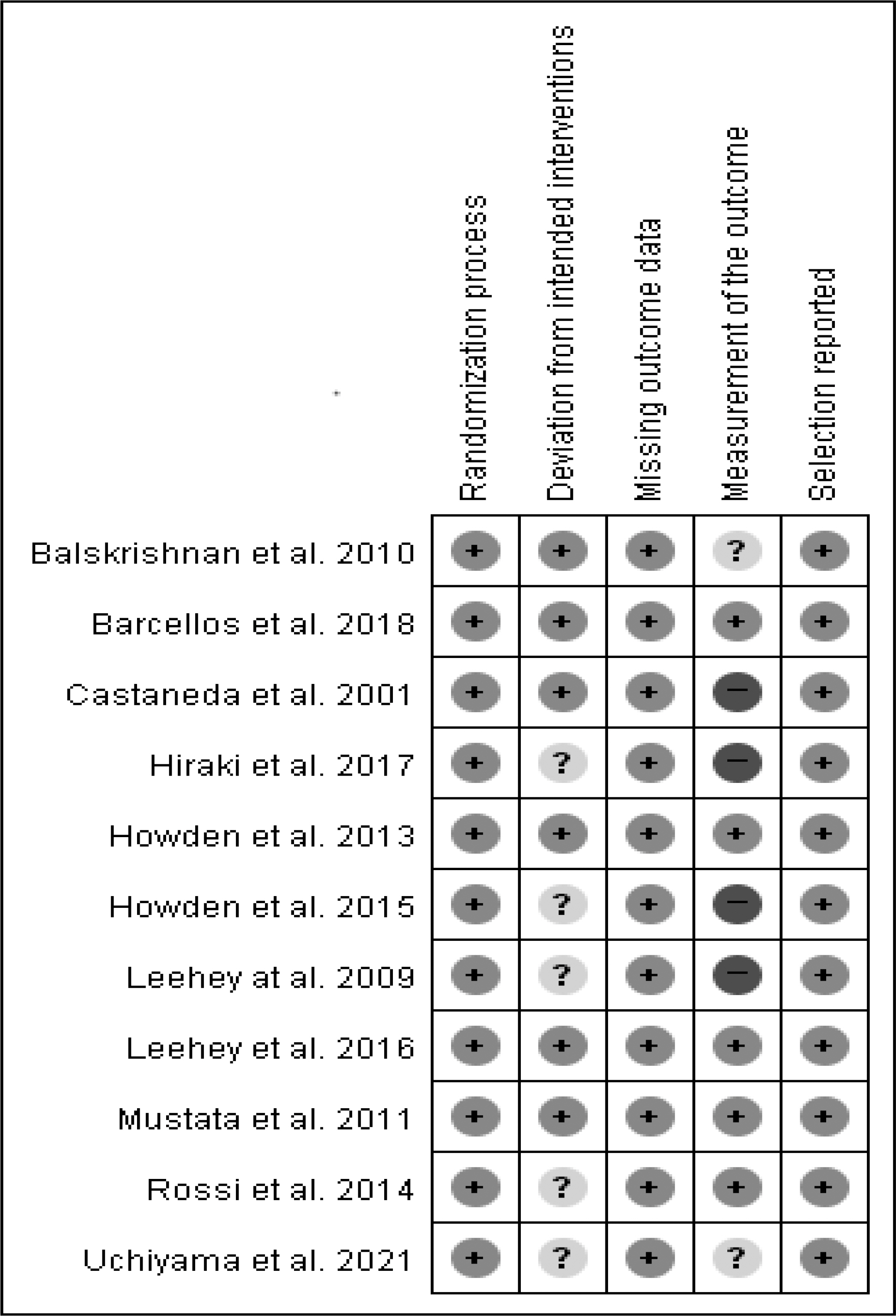
문헌의 질 평가는 최종 분석대상으로 선정된 11편의 문헌이 RCT임을 고려하여 무작위 대조군 실험 연구 평가방법인 Cochrane Collaboration의 Risk of Bias 2 (RoB 2; The Cochrane Collaboration, Copenhagen, Denmark) [16]를 이용하였다. RoB 2.0 도구는 무작위 대조군 실험 연구에 대한 비뚤림 위험 평가 도구로 무작위배정과정에서 발생하는 비뚤림(randomization process), 의도된 중재에서 이탈로 인한 비뚤림(deviations from intended interventions), 중재결과 자료의 결측으로 인한 비뚤림(missing outcome data), 중재결과 측정의 비뚤림(measurement of the outcome), 보고된 연구결과 선택의 비뚤림(selection of the reported result)의 총 5가지 항목에 대하여 평가자는 영역별 질문 및 알고리즘에 따라 비뚤림 위험이 낮음(low risk), 높음(high risk), 약간의 우려(some concerns)로 평가하였다. 평가는 2명의 연구자가 독립적으로 수행하였으며 연구자 간의 평가가 일치되지 않은 영역은 원문을 재검토하여 논의를 통해 제 3의 연구자와 최종 결론을 도출하였다.
4. 자료분석 및 합성
선정된 문헌의 특성은 기술통계로 제시하였으며, 메타분석은 Comprehensive Meta-Analysis software 4.0 version을 사용하여 운동 중재 적용에 따른 대상자의 신체기능 및 신기능 수준에 대한 효과크기를 검정하였다. 선정된 문헌에서 대상자의 운동중재의 유형, 중재기간 및 연구 참여자 등이 서로 다양한 점을 고려하여 고정효과모형(fixed effect model) 또는 임의효과모형(random-effects model)으로 산출하였다. 효과크기는 표준화된 평균차(standardized mean difference[SMD])의 방법을 사용하여 확인하였다. 이질성 여부를 판단하기 위해 시각적 검토(forest-plot)를 통해 신뢰구간과 효과 값이 방향이 같은 부분이 있는지 확인하고, 비일관성을 정량화시킨 통계량인 통계적 검토(Higgin's I2 통계량)를 통해 이질성을 평가하였다. I2는 총 효과크기의 분산에 대한 실제 분산의 비율을 나타내며, 이질성이 ‘25% 미만은 낮음’, ‘30∼60%는 중간’, ‘75% 이상은 매우 높음’으로 해석하였다[17]. 출판편향의 검정은 3편 이상의 문헌이 포함된 메타분석에서 실시하였으며, Egger's linear regression asymmetry test를 이용하였다[18].
5. 윤리적 고려
본 연구는 T대학교 생명윤리심의위원회의(institutional review borad [IRB])를 통해 승인(IRB No. 202304HR003) 후 수행되었다.
III. 연구결과
1. 분석대상 문헌선정
선정기준에 따라 문헌을 검색한 결과 국외 데이터베이스 중 PubMed에서 2,987편, Embase에서 3,928편, CINAHL에서 844편, Cochrane Library에서 404편, Web of Science에서 2290편이었으며, 수기로 검색한 문헌이 1편이었다. 국내 데이터베이스에서는 선정기준에 부합하는 한글 문헌은 검색되지 않았다. 중복된 문헌 9,375편을 제외하고 총 1,079편을 대상으로 선별하였으며, 배제기준에 따라 제목과 초록을 검토하고 선정기준에 적합하지 않은 1,046편을 제외하고 33편의 연구가 선정되었다. 선정된 문헌 중 한글이나 영어로 작성되지 않은 논문 2편, 연구설계 기준에 맞지 않은 논문 4편, 대조군 선정기준에 맞지 않은 논문 6편, 대상자 선정기준에 맞지 않은 연구 7편, 약물중재를 병행한 연구 3편의 총 22편의 논문이 제외되었다. 따라서 최종 11편의 문헌에 대해 체계적 문헌고찰을 시행하였으며, 그 중 효과크기 분석이 가능한 8편의 문헌에 대해서 메타분석을 수행하였다(Figure 1).
2. 문헌의 질 평가
문헌 선별과정에서 총 11편의 문헌이 선정되었고 RoB 2.0을 이용하여 질 평가를 수행하였다. 11편의 문헌 모두 컴퓨터 랜덤 배정, 번호 할당, 블록 무작위화 등 배정순서 생성과 배정순서의 은폐에 대한 기술이 구체적으로 제시되어있어 무작위 배정 과정의 비뚤림 위험이 낮은 것으로 평가되었다. 의도한 중재에서 이탈로 인한 비뚤림 위험은 연구참여자와 연구수행자 모두 눈가림이 지켜져 위험이 낮은 연구가 6편[A1,A3,A4,A5,A8,A10]이었으며, 5편은 눈가림 및 개입에 대한 내용이 구체적으로 제시되어 있지 않아 약간의 우려가 있음으로 평가되었다[A2,A6,A7,A9,A11]. 전체 연구에서 중재결과 자료의 결측에 대한 비뚤림은 없었으며, 중재결과 측정의 비뚤림 위험은 5편[A4,A5,A6,A8,A10]이 낮음, 2편[A1,A3]이 약간의 우려, 4편[A1,A2,A7,A9]이 높음으로 평가되었다. 근력 측정 등의 일부 결과가 눈가림이 되지 않았거나, 연구참여자와 수행자는 눈가림이 되었으나 연구평가자가 눈가림이 되지 않은 문헌이 악간의 우려 또는 높음으로 평가되었다. 보고된 연구결과 선택의 비뚤림 위험은 11편 모두 연구 프로토콜대로 진행하고 결과가 구체적으로 제시되어 분석이 이루어져 낮음으로 평가되었다(Figure 2).
3. 분석대상 문헌의 특성
체계적 문헌고찰을 위해 최종 선정된 11편의 문헌 특성은 Table 1과 같다. 출판연도는 2010년 이전에 출판된 문헌이 2편(18.2%), 2010년부터 2020년 사이에 출판된 문헌이 8편(72.7%), 2020년 이후 발표된 문헌이 1편(9.1%)이었다. 연구수행 국가는 미국 5편(45.5%), 호주 2편(18.2%), 일본 2편(18.2%), 캐나다(9.1%), 브라질(9.1%) 각각 1편씩이었다. 분석대상에 포함된 연구대상자 수는 총 591명으로 연령은 60.2세부터 76세까지였다. 대상자의 만성 신질환 단계는 2단계부터 4단계로 7편에서만 보고하였고, 사구체여과율은 15∼63.4ml/min/1.73m2였다.
운동중재의 특성을 살펴보면 운동장소는 대상자의 집과 체육관인 경우가 4편(36.3%), 집인 경우가 3편(27.3%), 의료기관이 2편(18.2%)이었으며 나머지 2편은 보고하지 않았다(18.2%). 운동중재 유형은 근력과 유산소가 결합된 운동이 7편(63.6%), 유산소운동이 2편(18.2%), 근력운동이 2편(18.2%)이었으며, 운동중재의 전달방법으로 전문가가 직접 전달 또는 감독한 경우가 9편(81.8%), 감독하지 않은 경우가 2편(18.2%)이었다. 운동중재의 회기는 주 3회가 6편(54.5%)으로 가장 많았으며, 주 1회(18.2%)와 주 5회(18.2%)가 각각 2편(18.2%), 주 2회가 1편(9.1%)이었다. 중재시간은 60분이 5편으로 가장 많았으며(45.5%), 보고하지 않은 1편을 제외한 모든 연구에서 30분 이상 운동을 수행하였다. 중재 기간은 52주가 5편(45.5%)으로 가장 많았으며, 12주가 3편(27.3%), 24주가 2편(18.2%), 16주가 1편(9.1%)이었다. 중재효과를 확인하기 위해 신체기능 및 신기능에 미치는 효과를 평가한 연구는 7편(63.6%)이었으며, 신체기능에 미치는 효과만 평가한 연구는 4편(36.4%)이었다(Table 2).
4. 운동중재의 효과
1) 신체기능에 미치는 효과
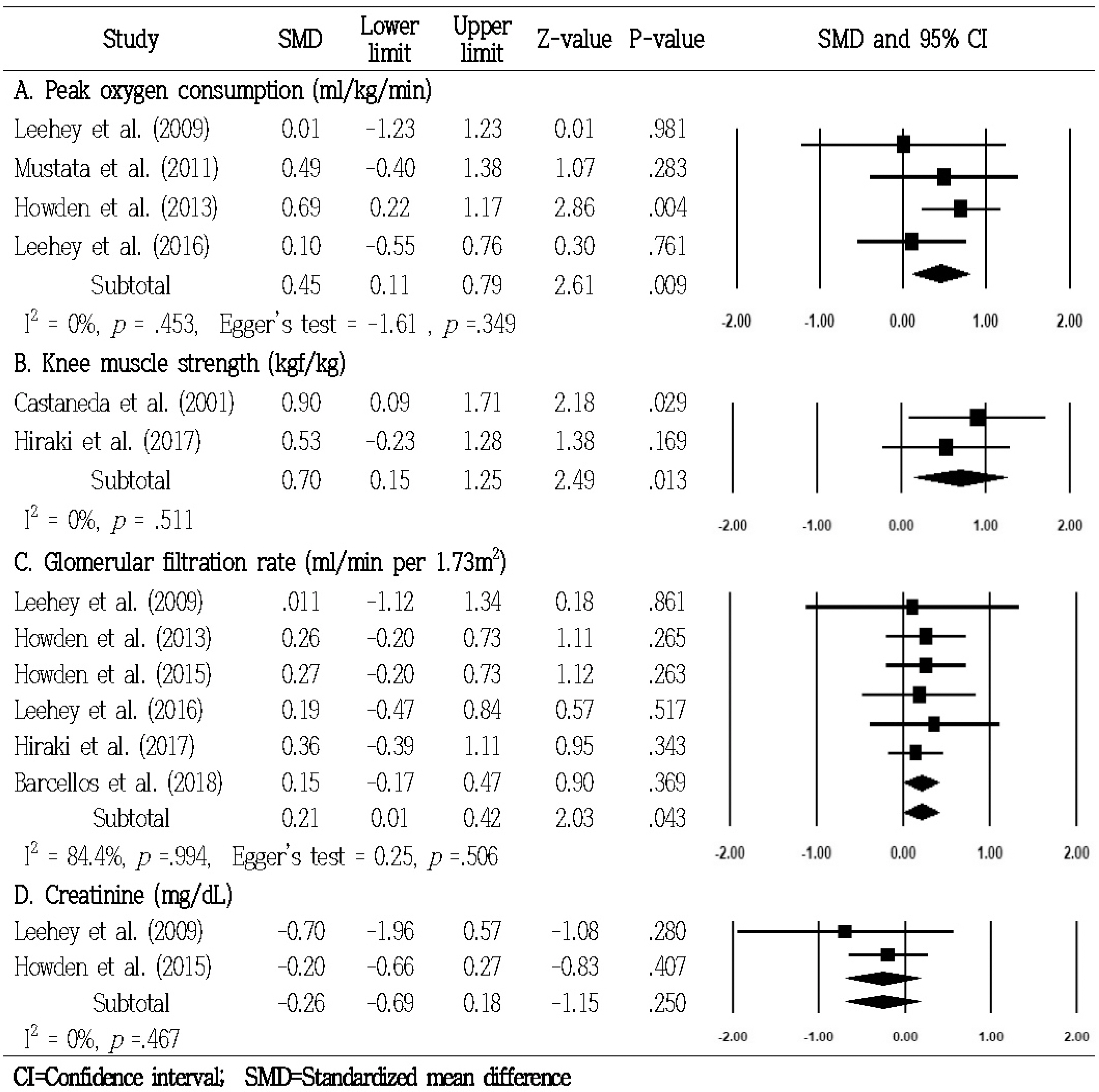
운동중재가 투석 전 만성 신질환 노인의 신체기능에 미치는 효과 중 최대 산소 소비량을 측정한 연구는 4편이었으며[A2, A4, A5, A8], 문헌 간 이질성은 없는 것으로 분석되어 고정효과모형을 이용하여 분석하였다(p=.453; I2=0%). 분석결과, 운동중재의 효과크기는 0.45 (95% CI: 0.11 to 0.79)이며, 통계적으로 유의하였다(Z=2.61, p=.009)(Figure 3). 또 다른 신체기능으로 무릎관절의 근력을 측정한 연구는 2편이었으며[A1, A9], 문헌 간 이질성은 없는 것으로 분석되어 고정효과모형을 이용하여 분석하였다(p =.511; I2=0%). 분석결과 운동중재의 효과크기는 0.70 (95% CI: 0.15 to 1.25)이며, 통계적으로 유의하였다(Z=2.49, p =.013)(Figure 3).
2) 신기능에 미치는 효과
운동중재가 투석 전 만성 신질환 노인의 신기능에 미치는 효과 중 사구체여과율을 측정한 연구는 6편이었으며[A2, A5, A7-A10], 문헌 간 이질성이 확인되어 랜덤효과모형을 이용하여 분석하였다(p =.994; I2=84.45). 분석결과 운동중재의 효과크기는 0.21 (95% CI: 0.01 to 0.42)이며, 통계적으로 유의하였다(Z=2.03, p=.043) (Figure 3). 또 다른 신기능으로 크레아티닌을 측정한 연구는 2편이었으며[A2, A7], 문헌 간 이질성은 없는 것으로 분석되어 고정효과모형을 이용하여 분석하였다(p =.467; I2=0%). 분석결과 운동중재의 효과크기는-0.26 (95% CI:-0.69 to 0.18)로, 두 그룹 간 통계적으로 유의한 차이는 없었다(Z=-0.26, p =.250)(Figure 3).
5. 출판 편향 검정
출판편향은 Egger's linear regression asymmetry test를 이용하여 분석이 가능한 최대 산소 소비량과 사구체여과율을 검정하였으며, 최대 산소 소비량(p=.349)과 사구체여과율(p =.506)은 출판편향이 없는 것으로 확인되었다(Figure 3).
IV. 논 의
본 연구는 체계적 문헌고찰과 메타분석을 통해 운동중재가 투석 전 단계인 만성 신질환 노인의 신체기능 및 신기능에 미치는 효과를 파악하기 위해 시도되었다. 본 연구에 포함된 논문은 총 11편으로 그 중 8편이 메타분석에 포함되었다.
본 연구의 체계적 고찰 결과, 대상자의 연령은 60세부터 76세까지였다. 노인은 노화가 진행됨에 따라 신체기능뿐만 아니라 신장의 기능적 및 구조적 변화를 겪고 사구체여과율 감소가 뚜렷이 나타나며[19] 만성 신질환의 유병률 또한 중년층에 비해 높다[20]. 국내 만성 신질환 유병률은 2021년 기준 8.4%로 연령이 높을수록 유병률이 높아져 70세 이상에서는 26.5%에 달하였으며, 최근 10년간 만성 신질환 진료환자수와 진료비 모두 2배 이상 증가하였다[21]. 따라서 만성 신질환 노인의 신체 및 신장의 기능적 악화를 예방하는 건강관리체계가 필요하며 이를 수행하기 위한 지속적 관심과 관련 연구가 활발히 진행될 필요가 있겠다.
본 연구결과를 통해 확인된 운동중재의 특성을 살펴보면, 포함된 11편의 문헌들 중 7편(63.6%)이 집이 포함된 장소에서 운동을 수행하였다. 반면, 클리닉에서만 수행된 연구는 2편(18.1%) 뿐이었다. 이는 노화로 인해 보행 및 신체활동의 제약과 교통수단을 이용한 이동에 대한 부담으로 접근성이 용이한 집을 포함한 장소가 높은 비율을 차지하는 것으로 여겨진다. 선행연구에서도 의료시설의 접근성이 높은 경우 노인의 건강상태에 유익한 영향을 미치는 것으로 확인되었다[22]. 그러므로 향후 노인 대상 운동중재 연구 시 수행 장소에 대한 접근성을 고려하여 설계할 필요가 있다. 또한, 운동중재의 유형으로는 유산소 및 근력이 함께 병행된 복합운동이 7편(63.6%)으로 가장 많았다. 노화는 근골격계의 생리학적 변화를 촉진하여 체력과 균형감각의 소실 및 근감소증(sarcopenia)을 유발하며, 이는 신체활동 감소로 이어져 유산소능력의 저하 및 심폐기능의 약화를 초래한다. 때문에 만성 신질환 노인의 규칙적인 운동은 기능적 수행 향상에 중요한 요인이 된다. 선행연구에서도 복합운동이 근력, 심혈관계, 신체기능 및 삶의 질 등에서 이점이 있는 것으로 확인되었으며[23], 신기능인 사구체여과율 향상 및 혈청 크레아티닌과 단백뇨 감소에 유의하였다[24]. 다만 본 연구에서는 포함된 분석대상 논문 수가 적어서 운동중재 유형에 따른 신체기능 및 신기능의 효과의 차이를 비교하기는 어려웠으므로 향후 연구의 수가 충분히 확보되어지면 운동중재 유형에 따라 효과를 차이를 비교하는 연구가 필요할 것이다.
본 연구결과, 운동중재의 전달방식은 운동생리학자 등이 직접 전달 및 감독한 문헌이 9편(81.8%)을 차지하였다. 선행연구에서도 노인을 대상으로 운동중재를 수행할 경우 운동전문가의 개입이 중요하다고 강조하였다[25]. 노년기에는 동일한 연령에서도 노화로 인해 기초 체력 및 건강상태, 감각 기관 기능의 저하 등에 따라 신체적으로 개인차가 나타날 수 있다. 따라서 노인대상 운동중재를 수행할 때에는 이러한 노인기의 특성을 이해한 운동전문가의 개입이 필요하며, 대상자에게 적합한 운동방법, 시간, 강도 등을 개별화하여 지도 및 감독을 해야 할 것이다. 한편, 본 연구에 포함된 연구의 수는 운동의 지도여부, 시간, 회기, 운동 강도에 따라 계층화하기에 부적절하였다. 그러므로 포함된 연구를 기반으로 운동중재의 내용을 정리하였다. 포함된 11편 중 9편이 운동을 감독해주는 전문가가 있었고, 6편이 일주일에 3번 이상 운동하였으며 11편 모두 30분 이상 운동중재가 시행되었다. 결과적으로 투석 전단계 만성 신질환 노인을 위한 운동중재를 고안할 때 일주일에 3회, 각 운동시간은 30분 이상 시행하며 운동전문가의 감독하에 운동을 지도하는 것을 고려해야 할 것이다.
본 연구의 메타분석 결과, 운동중재가 투석 전 단계인 만성 신질환 노인의 신체기능 중 최대 산소소비량의 향상에 유의한 효과가 있는 것으로 나타났다. 이 중 2편은 유산소운동을 수행하였고, 2편은 복합운동을 시행하여 모두 유산소운동을 포함하였다. Pei 등[26]의 메타분석 연구에서도 만성 신질환 환자를 대상으로 유산소운동을 제공한 결과, 최대산소소비량 상승에 유의한 효과가 있었다. 또한 선행연구에서 만성 신질환 환자의 주요 사망요인 중 하나인 심혈관질환의 위험이 최대산소소비량이 증가함에 따라 유의하게 감소하였다[27]. 이처럼 유산소를 포함한 운동중재를 지속한다면 심폐기능의 강화를 통해 최대 산소소비량이 향상될 것이고, 장기적으로 심혈관질환 감소 및 생존률 상승에도 도움이 될 것으로 기대할 수 있다. 반면, 분석대상 문헌들 중 근력운동을 통한 심폐기능 변화는 확인할 수 없었다. 향후 근력운동이 만성 신질환 노인의 심폐기능 변화에 미치는 효과에 대한 추가 연구가 필요하다 생각된다. 또한 본 연구에서 운동중재는 신체기능 중 무릎관절근력 향상에도 유의한 효과가 있었다. 근력은 만성 신질환 환자들의 신체활동에 필수적인 요소이나 만성 신질환이 진행될수록 신체활동 제한 및 근골격계 장애로 근감소증이 나타난다[28]. 근감소증은 근육량 및 기능의 점진적인 감소를 특징으로 허약, 장애 및 사망 위험 증가와 깊은 관련이 있다[29,30]. 특히, John 등[31]의 연구에 따르면 투석 전 단계의 만성 신질환 환자가 투석 중인 환자에 비해 근육감소가 더 빠르게 나타났다. 따라서 만성 신질환 노인은 투석 전 단계에서부터 근육손실을 예방하고 근골격계의 기능을 유지할 수 있는 지속적인 노력이 필요하다.
본 연구에서 운동중재는 신장의 기능을 평가하는 지표인 사구체여과율의 향상에 유의한 효과가 있었다. 총 6편이 사구체여과율을 평가하였으며 유산소운동 1편을 제외하고 모두 복합운동을 제공하였다. 선행 메타분석 결과들에서도 복합운동과 유산소운동 모두 사구체여과율 향상에 유의하였다[24,32]. 이처럼 선행연구 결과와 함께 미루어 볼 때, 운동중재는 만성 신질환 환자의 신장기능 악화를 예방하기 위한 전략으로 유용하며, 건강관리 전략으로 고려해야 할 것이다. 그러나 운동중재가 혈청 크레아티닌의 감소에는 유의하지 않아 선행 메타분석에서 확인된 혈청 크레아티닌의 감소가 유의하게 나타난 결과와는 대조적이다[24]. 다만, 선행연구의 대상자 평균 연령대는 48세∼61세이었으며, 본 연구에서는 60세∼66세로 차이가 있었다. 또한, 혈청 크레아티닌은 정량화하기 쉬우나 사구체여과율이 크게 감소할 때만 상당히 증가하는 경향이 있으며, 연령, 성별, 근육량 및 인종에 의해 영향을 받기 때문에[33] 추가 연구를 통한 그 효과를 검증할 필요가 있다.
본 연구는 체계적 문헌고찰 및 메타분석을 통해 투석 전 단계인 만성 신질환 노인의 신체 및 신기능 유지를 돕기 위한 운동중재 개발의 방향성을 제시한 본 연구의 의의에도 불구하고, 다음과 같은 제한점이 있다. 첫째, 포함된 문헌 수와 대상자의 수가 적어 메타분석 결과를 일반화하기에 한계가 있으므로 충분한 대상자 수를 확보한 연구가 진행되어야 할 것이다. 둘째, 연구 특성상 중재결과 측정 시 눈가림을 보고하지 않은 연구가 다수 포함되었다. 부적절한 눈가림은 내적 타당도를 위협하는 요인으로 추후에는 연구설계부터 눈가림에 대한 적합한 방법 및 내용을 고려해야 할 것이다. 마지막으로 본 연구는 영어와 한국어로 작성된 문헌만을 포함하였기에 국가 및 문화적 편중의 가능성이 있으므로 결과를 해석할 때 주의가 요구된다.
V. 결론 및 제언
본 연구에서는 투석 전 단계인 만성 신질환 노인에게 적용된 11편의 RCT 운동중재 문헌을 대상으로 신체 및 신기능에 미치는 효과를 분석하여 객관적이고 통합적인 근거를 제시하고자 체계적 문헌고찰 및 메타분석을 시행하였다. 그 결과, 운동중재가 최대산소소비량, 무릎관절 근력 및 사구체여과율 향상에 효과가 있음을 확인하였다. 노화로 인해 신체기능 저하 및 만성 신질환의 악화가 진행되고 있는 노인을 대상으로 투석 전 단계부터 운동중재를 통한 예방 및 관리가 효과가 있음을 입증하였고 RCT 연구만을 대상으로 분석하였기에 운동중재 개발의 기초자료로써 기여할 수 있을 것이다. 향후 연구에서는 운동중재의 유형, 강도, 시간, 지도여부 등을 더욱 세분화하여 연구가 수행되어야 할 것이며, 본 연구에서 확인하지 못한 정신건강 및 삶의 질과 관련된 다양한 변수의 효과를 평가해 볼 것을 제언한다.